Catalizadoras
Las enzimas son proteínas que incrementan la velocidad de una reacción química y no se consumen durante la misma (algunos tipos de ARN pueden actuar como enzimas, usualmente rompen y sintetizan enlaces fosfodiéster; a estas moléculas se les denomina “ribozimas” y se encuentran en muy baja proporción en la naturaleza).
Son muy Específicas
Las enzimas son muy específicas para los reactivos o sustratos sobre los que actúan, y varía el grado de especificidad hacia el sustrato. Algunas enzimas actúan sobre un grupo de sustratos relacionados y otras sólo sobre un simple compuesto. Muchas enzimas poseen estereoespecificidad ya que sólo actúan sobre un estereoisómero del sustrato. Quizá
el aspecto más importante de la especificidad de una enzima es la especificidad de reacción, esto es, la falta de formación de subproductos como desperdicios.
Acoplan Reacciones
Algunas también pueden combinar, o acoplar, dos reacciones que
normalmente serían separadas. Esta propiedad permite que la energía ganada en una
reacción se use en una segunda reacción. Las reacciones acopladasson una propiedad
común de muchas enzimas; por ejemplo, la hidrólisis del ATP se acopla con frecuencia
a reacciones metabólicas menos favorables.
Tipos de Enzimas
Los nombres en la mayor parte de las enzimas metabólicas se forman agregando el sufijo —asa al nombre de sus sustratos, o a un término descriptivo de la reacción que catalizan. Por ejemplo, la ureasa tiene a la urea como sustrato. La alcohol deshidrogenasa cataliza la remoción de hidrógeno de los alcoholes (es decir, la oxidación de alcoholes).
Existen 6 clases de enzimas:
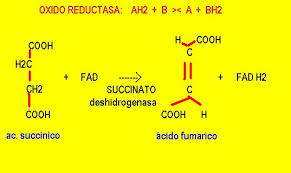
1. Las oxidorreductasas catalizan las reacciones de oxidación-reducción. La mayor parte de esas enzimas se llaman, en general, deshidrogenasas. También hay
otras enzimas en esta clase que se llaman oxidasas, peroxidasas, oxigenasas o reductasas.
2. Las Transferasas
| Catalizan la transferencia de un grupo químico (distinto del hidrógeno) de un sustrato a otro, según la reacción: |
| Un ejemplo es la glucoquinasa, que cataliza la reacción representada en la Figura de la derecha: |
4. Liasas: Catalizan reacciones de ruptura o soldadura de sustratos.
5. Isomerasas: Catalizan la interconversión de isómeros:
6. Ligasas:
| Catalizan la unión de dos sustratos con hidrólisis simultánea de un nucleótido trifosfato (ATP, GTP, etc.) |
Cinetica Enzimatica
Uno de los primeros y grandes avances en bioquímica, fue el descubrimiento de que las
enzimas se unen en forma transitoria a los sustratos, resultado de la investigación de la
cinética enzimática. Emil Fischer, en 1894, propuso que una enzima presenta una plantilla rígida, o cerradura, y que el sustrato es la llave que le corresponde. Sólo los sustratos específicos se pueden ajustar a determinada enzima. Los primeros estudios de
cinética enzimática confirmaron que una enzima (E) se une a un sustrato para formar un
complejo enzima-sustrato(ES). Los complejos ES se forman cuando los ligandos se
unen de manera no covalente a sus lugares adecuados en el sitio activo. El sustrato reacciona en forma transitoria con la proteína catalizadora (y con otros sustratos, en una
reacción multisustratos) para formar el producto de la reacción.
Imagínese ahora una reacción enzimática simple, la conversión de un sustrato en
un producto catalizada por una enzima. Aunque la mayor parte de las reacciones enzimáticas tiene dos o más sustratos, se pueden describir los principios generales de la cinética enzimática suponiendo el caso sencillo en que hay un sustrato y un producto
Esta es llamada la ecuación de Michaelis-Menten, por Leonor Michaelis y Maud
Menten.La ecuación de Michaelis-Menten describe la relación entre la velocidad inicial de una
reacción y la concentración del sustrato. En la sección que sigue se deducirá la ecuación
de Michaelis-Menten por un método cinético para después examinar el significado de
las diversas constantes.
Constante Catalítica
Cuando la concentración de sustrato es alta, la velocidad total de la reacción es Vmáx yestá determinada por la concentración de la enzima. La constante de velocidad observada bajo estas condiciones se llama constante catalítica, Kcat, y se define como sigue:
Vmáx=kcat[E]total kcat =Vmáx[E]total
donde kcat,representa la cantidad de moles de sustrato convertidos en producto, por segundo y por mol de enzima (o por mol de sitio activo, para una enzima con multisubunidades) bajo condiciones de saturación. En otras palabras, kcat indica la cantidad máxima de moléculas de sustrato convertidas en producto cada segundo por cada sitio activo. A eso se le llama con frecuencia número de recambio.
Inhibición reversible de enzimas
Un inhibidor de enzima (I) es un compuesto que se enlaza con una enzima e interfiere con su actividad. Los inhibidores pueden actuar evitando la formación del complejo ES o bloqueando la reacción química que lleva a la formación del producto. Por regla general, los inhibidores son moléculas pequeñas que se unen en forma reversible con la enzima que inhiben. Las células contienen muchos inhibidores enzimáticos naturales que juegan papeles importantes en la regulación del metabolismo. Los inhibidores artificiales se usan en experimentos para investigar los mecanismos enzimáticos y para descifrar las rutas metabólicas. Algunas medicinas y muchos venenos son inhibidores de enzimas.Algunos inhibidores se unen en forma covalente con las enzimas y causando que la inhibición sea irreversible. La mayor parte de la inhibición de relevancia biológica es reversible. Los inhibidores reversibles se unen a las enzimas con las mismas fuerzas no covalentes que enlazan a sustratos y productos. Los inhibidores reversibles se diferencian de los irreversibles por su fácil eliminación de soluciones de enzima por métodos como diálisis o filtración en gel.
A.Inhibición competitiva
Los inhibidores competitivos son los que se encuentran con más frecuencia en bioquímica. En la inhibición competitiva, el inhibidor sólo se puede unir a moléculas de enzima libre que no estén unidas a sustrato alguno. La formación de un complejo EI quita a la enzima de su ruta normal.
Cuando un inhibidor competitivo se une con una molécula de enzima, una molécula de sustrato no puede unirse a esa molécula de enzima. Al revés, la unión de sustrato y una molécula de enzima evita el enlazamiento de un inhibidor. En otras palabras, S e I compiten por unirse a la molécula de enzima. Más comúnmente, S e I se unen al mismo sitio de la enzima, el sitio activo.
B.Inhibición acompetitiva
Los inhibidores acompetitivos sólo se unen al ES y no a la enzima libre. En la inhibición acompetitiva disminuye la Vmáx(aumenta 1/Vmáx) por conversión de algunas moléculas de E en la forma inactiva ESI. Ya que es el complejo ES el que se enlaza con I y la disminución de Vmáx no se revierte por la adición de más sustrato.
También, los inhibidores acompetitivos hacen descender la Km(vista como un aumento del valor absoluto de 1/Km en una gráfica de doble recíproco) ya que los equilibrios de formación de ES y de ESI son desplazados hacia los complejos, por la unión de I. Experimentalmente, las líneas de una gráfica de doble recíproco representando concentraciones variables de un inhibidor acompetitivo, tienen todas la misma pendiente, lo que indica que los valores de Km y de Vmáx decrecieron proporcionalmente. Este tipo de inhibición suele presentarse en las reacciones de multisustrato.
C.Inhibición no competitiva
Los inhibidores no competitivos se pueden unir a la E o al ES y formar complejos inactivos EI o ESI, respectivamente. Esos inhibidores no son análogos del sustrato y no se enlazan en el mismo sitio que el S. El caso clásico de inhibición no competitiva se caracteriza por una disminución aparente de Vmáx(1/Vmáx parece aumentar) sin cambiar de la Km. En una gráfica de doble recíproco, las líneas de la inhibición no competitiva clásica se cruzan en el punto del eje x que corresponde a –1/Km
(figura 5.12b). Está ordenada al origen común indica que Km no se afecta. El efecto de
la inhibición no competitiva está dada por la interacción del I con la E y el ES en forma reversible, eliminando las moléculas de enzima activa en la solución. Esta inhibición no se puede compensar agregando S. Es rara la inhibición no competitiva clásica, pero se conocen ejemplos entre las enzimas alostéricas. En esos casos, es probable que el inhibidor no competitivo altere la conformación de la enzima, cuya forma todavía le permita seguir uniéndose al S pero sin poder catalizar reacción alguna.
Inhibición enzimática irreversible
En contraste con un inhibidor enzimático reversible, un inhibidor enzimático irreversible
forma un enlace covalente estable con una molécula de enzima y elimina así las moléculas del sitio activo en la población enzimática. Típicamente, la inhibición irreversible ocurre por alquilación o acilación de la cadena lateral de un residuo de aminoácido en el sitio activo. Hay muchos inhibidores irreversibles naturales, al igual que hay ejemplos sintéticos que se describirán aquí. Una aplicación importante de los inhibidores irreversibles es la identificación de residuos de aminoácidos en el sitio activo, por sustitución específica de sus cadenas laterales reactivas. En este proceso, un inhibidor irreversible que sólo reacciona con un tipo de aminoácido se incuba con una solución de la enzima, la que a continuación es analizada para determinar su pérdida de actividad. Las cadenas laterales ionizables se modifican con reacciones de acilación o alquilación. Por ejemplo, los grupos amino libres, como el grupo e-amino de la lisina, reaccionan con un aldehído para formar una base de Schiff, la cual se puede estabilizar por reducción con borohidruro de sodio (NaBH4).
Enzimas Alostéricas
Las enzimas alostéricas son enzimas cuyas propiedades son afectadas por cambios en la
estructura. Los cambios estructurales son ocasionados por interacción con moléculas
pequeñas. Se planteó un ejemplo de alosterismo en el capítulo anterior al examinar la
unión del oxígeno a la hemoglobina. Con frecuencia, las enzimas alostéricas no presentan cinética clásica de Michaelis-Menten debido a su unión cooperativa del sustrato, como el caso de la hemoglobina, que no es enzima.
Los moduladores alostéricos se unen a las enzimas en un sitio distinto al sitio activo y alteran la actividad enzimática. Hay dos modelos, el modelo concertado y el modelo secuencial, que describen la cooperatividad de las enzimas alostéricas. La modificación covalente, por lo general fosforilación,
de ciertas enzimas reguladoras también puede regular la actividad enzimática.
FÁRMACOS INHIBIDORES DE LA ENZIMA CONVERTIDORA DE ANGIOTENSINA (IECA)
Los inhibidores de la ECA ( Enzima convertidora de angiotensina ), como su nombre indica, inhiben la enzima responsable de convertir la angitensina I en angiotensina II (La enzima peptidil-dipeptidasa) , un potente vasoconstrictor y estimulador de la aldosterona. La aldosterona estimula la reabsorción de Na y de H2O. Por ello, inhibir la enzima que convierte la angitensina I en angitensina II supone por un lado un efecto vasodilatador (hipotensor) y por otro lado efecto diurético que supone menor volumen sanguíneo y en consecuencia menor retorno sanguíneo al corazon. ( al inhibir la secrecion de aldosterona). Esto supone además de un efecto hipotensor, una gran utilidad para la insuficiencia cardiaca.De todas formas, la aldosterona, escapaz de absorver Na y H2O, pero no potasio, por lo que sigue habiendo reabsorción de potasio. Por consiguiente, es importante monitorizar sus niveles.
La primera sustancia capaz de inhibir esta enzima, fue el TEPRÓTIDO, obtenido a partir de el veneno de un tipo de vívora; lo que sucede es que esta sustancia era inactiva por via oral.
En 1971 se sintetiza el CAPTOPRILO; y a partir de esa fecha se sintetizaron sustancias de efectos similares pero propiedades clincicas diferentes: enalaprilo, lisinoprilo, quinaprilo, alaceprilo...que son sustancias mas recientes, muy seguras y efectivas.
Este grupo de fármacos, ha obtenido resultados muy satisfactorios, por lo que se le considera como de primera elección en el tratamiento de la hipertensión; además se ha demostrado su eficacia en lainsuficiencia cardiaca congestiva, con ciertas ventajas frente a los vasodilatadores: reducción de la presión sanguínea y la resistencia vascular periférica y pulmonar, mejora de la funcion ventricular izquierda, sin apenas modificación en la frecuencia cardiaca.
Dentro de los IECAs, distinguimos:
CAPTOPRILO
Mecanismo de Acción
Inhibidor del ECA da lugar a concentraciones reducidas de angiotensina II, que conduce a disminución de la actividad vasopresora y secreción reducida de aldosterona.
Dosis
 Oral. Dosis máx. recomendada: 150 mg/día.
Oral. Dosis máx. recomendada: 150 mg/día.- HTA: inicial: 25-50 mg/día en 2 tomas. Aumento gradual a intervalos mín. de 2 sem hasta 100-150 mg/día (2 tomas). En pacientes con sistema renina-angiotensina-aldosterona muy activo iniciar con 6,25 mg ó 12,5 mg/día, después cada 12 h; si fuera necesario, aumentar gradualmente hasta 50-100 mg/día en 1 ó 2 dosis.

ENALAPRILO
Mecanismo de Acción
Inhibidor del ECA da lugar a concentraciones reducidas de angiotensina II, que conduce a disminución de la actividad vasopresora y secreción reducida de aldosterona.
Dosis
 Oral:
Oral:- HTA: inicial: 5-20 mg/día; con sistema renina-angiotensina-aldosterona muy activo: 5 mg o menos. Mantenimiento: 20 mg/día; máx. 40 mg/día.
- Insuf. cardiaca sintomática y prevención de la misma con disfunción ventricular izda. asintomática (fracción de eyección ≤ 35%): se usa con diuréticos y si es apropiado con digitálicos o ß-bloqueante. Inicial: 2,5 mg, aumentar gradualmente (2 a 4 sem) hasta mantenimiento: 20 mg, en 1 ó 2 tomas; máx. 40 mg/día en 2 tomas.
Efectos secundarios y efectos adversos de los IECAs
Todos los IECAs tienen efectos perjudiciales en el feto y el neonato. Son fármacos de categoría C de riesgo gestacional en el primer trimestre de gestación y de categoría D en el segundo o tercer trimestre.
No debe usarse en embarazadas a no ser que no existan otras alternativas mas seguras.
Estos fármacos se contraindican en pacientes con hipersensibilidad a ellos, en mujeres lactantes, en niños y en pacientes con bloqueo cardiaco o estenosis bilateral de las arterias renales.
Los efectos que la reducción de aldosterona pueden causar, se exponen anterionmente, pero debe añadirse en su caso extremo la neurotropenia y la proteinuria, aunque en casos muy raros. Finalmente, se ha asociado con su ingesta, la aparicion de gromerulonefritis membranosa.
Los efectosefectos mas importantes de los IECAs sobre el SNC son entre otros , fatiga, vertigo, cambio en el estado de animo y cefalea.
Aparece una tos seca e improductiva al ceasr la terapia.
La accion hipotensora, puede producir un importante descenso en la presion arterial.
Otros efectos secundarios son perdida de gusto, proteinuria, anemia, exantema, neutropenia, trombocitosis y agranulocitosis
Toxicidad y tratamiento de la sobredosis
El síntoma más característico de la sobredosis con IECAs es la hipotension. El tratamiento es sintomatico y de soporte, e incluye la administración de liquido intravenoso y la hemodiálisis para extraer el captopril y el lisinopril.
Otros IECAs: Ademas de los antriormente citados, se clasifican también dentro de los IECAs, el benacepril, Cinazopril, Fosinopril, Perindopril, Quinapril y Ramipril.













No hay comentarios:
Publicar un comentario