En el estudio de la bioquímica es importante comprender al agua y sus propiedades. Los componentes macromoleculares de las células —proteínas, polisacáridos, ácidos nucleicos y membranas— asumen sus formas características como respuesta al agua.
Algunos tipos de moléculas interaccionan en forma extensa con el agua y en consecuencia son muy solubles. Otras moléculas no se disuelven con facilidad en el agua y tienden a asociarse entre sí para evitar el agua. Gran parte de la maquinaria metabólica de las células debe operar en un ambiente acuoso porque el agua es un solvente esencial y también un sustrato de numerosas reacciones celulares.
Este estudio detallado de la química de la vida comenzará examinando las propiedades del agua. Sus propiedades físicas le permiten funcionar como solvente de sustancias iónicas y polares, mientras que sus propiedades químicas condicionan que forme enlaces débiles con otros compuestos, incluso otras moléculas de agua. Las propiedades químicas del agua se relacionan también con las funciones de las macromoléculas, de las células y de los organismos completos. Dichas interacciones son importantes en la estabilidad estructural de las macromoléculas y de las células.
La Molécula del Agua es Polar
La molécula de agua (H2O) tiene forma de V y el ángulo entre los dos enlaces covalentes O—H es de 104.5°. Algunas propiedades importantes del agua se deben a la forma angulada y a los enlaces intermoleculares que puede formar. Un átomo de oxígeno tiene ocho electrones y su núcleo cuenta con ocho protones y ocho neutrones. Hay dos electrones en la capa interna y seis en la capa externa de este átomo.
El ángulo del enlace H—O—H en el agua es de 104.5°, pero si los orbitales electrónicos apuntaran en realidad a las cuatro esquinas de un tetraedro el ángulo sería de 109.5°. La explicación normal de esta diferencia es que existe una fuerte repulsión entre pares de electrones solitarios y esa repulsión trata de unir los enlaces covalentes, con reducción del ángulo de 109.5° a 104.5°.
Las Sustancias Iónicas y Polares se disuelven en agua.
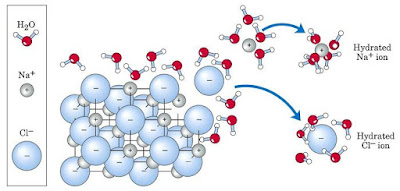
El agua puede interactuar y disolver otros compuestos polares y compuestos que se ionizan. La ionización se relaciona con la ganancia o pérdida de un electrón, que da lugar a un átomo o a un compuesto que presenta una carga neta. Las moléculas que se pueden disociar y formar iones se llaman electrólitos. Las sustancias que se disuelven con facilidad en agua se llaman hidrofílicaso amantes del agua. (Las sustancias hidrofóbicas, que odian al agua, se describen en la próxima sección).¿Por qué los electrolitos son solubles en agua? Recuérdese que las moléculas de agua son polares, lo cual significa que se pueden alinear entre sí, en torno a los electrólitos, para que los átomos negativos de oxígeno en las moléculas de agua se orienten hacia los cationes(iones con carga positiva) de los electrolitos, y los átomos positivos de hidrógeno se orienten hacia los aniones(átomos con carga negativa). Imagínese lo que sucede cuando un cristal de cloruro de sodio (NaCl) se disuelve en agua.
Las moléculas polares de agua son atraídas hacia los iones cargados en el cristal. Las atracciones hacen que los iones sodio y cloruro, en la superficie del cristal, se disocien entre sí y que el cristal comience a disolverse. Como hay muchas moléculas polares de agua rodeando a cada ion sodio y cloro disueltos, las interacciones entre las cargas eléctricas opuestas de esos iones son mucho más débiles que lo que hay en el cristal intacto. El resultado de sus interacciones con moléculas de agua es que los iones del cristal se continúen disociando hasta que la solución se satura. En este momento, los iones del electrólito disuelto están presentes en concentraciones suficientemente altas para que se
vuelvan a unir al electrólito sólido, cristalizándose, hasta que se establece el equilibrio
entre disociación y cristalización.
Escala de pH
Existen varios procesos bioquímicos —como el transporte de oxígeno en la sangre, la catálisis de reacciones con enzimas y la generación de energía metabólica durante la respiración o la fotosíntesis— que están muy influidos por la concentración de protones. Aunque la concentración de H (o H3O)
en las células es pequeña en relación con la concentración del agua, el intervalo de [H] en soluciones acuosas es enorme, por lo que conviene usar una cantidad logarítmica llamada pH como medida de la
concentración de H. El pH se define como el logaritmo negativo de la concentración de H.
Aquí le presentamos un video para comprender mejor acerca de las propiedades fisicas y quimicas del Agua.
Constante de Disociacion de Acidos débiles
Los ácidos y bases que se disocian por completo en agua, como el ácido clorhídrico y el
hidróxido de sodio, se llaman ácidos fuertes y bases fuertes. Hay muchos otros ácidos y
bases, como por ejemplo los aminoácidos que forman las proteínas y las purinas y pirimidinas del ADN y ARN, que no se disocian por completo en el agua. A dichas sustancias se les conoce como ácidos débiles y bases débiles.
El HCl es un ácido porque puede donar un protón. En este caso el aceptador de protón
es el agua, que es la base en esta reacción de equilibrio. En el otro lado del equilibrio están los iones Cl y el hidronio H3O. El ion cloruro es la base que corresponde al HCl después que cede su protón. Al Cl se le llama la base conjugada del HCl, lo que indica que es una base, es decir, que puede aceptar un protón, y es parte de un par ácido base (es decir, HCl/Cl). De igual modo, el H3O es el ácido en el lado derecho del equilibrio porque puede donar un protón. H3O es el ácido conjugado del H2O. Toda base tiene un ácido conjugado correspondiente, y todo ácido tiene una base conjugada correspondiente. Así, el HCl es el ácido conjugado del Cl, y el H2O es la base conjugada del H3O. (Nótese que H2O es el ácido conjugado del OH cuando se hace referencia al par ácido-base H2O/OH).






No hay comentarios:
Publicar un comentario